Номер 214, страница 38 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 2. Строение атома и периодический закон. Параграф 8. Явление радиоактивности - номер 214, страница 38.
№214 (с. 38)
Условие. №214 (с. 38)
скриншот условия

214. Вставьте вместо знаков вопроса необходимые частицы:
а) $ ^{32}\text{S} + ^{4}\text{He} = ? + ^{2}\text{H}; $
б) $ ^{14}\text{N} + ^{1}\text{n} = ? + ^{1}\text{H}; $
в) $ ^{238}\text{U} + ^{1}\text{n} = ?; $
г) $ ^{239}\text{Np} = ? + \text{e}. $
Решение. №214 (с. 38)
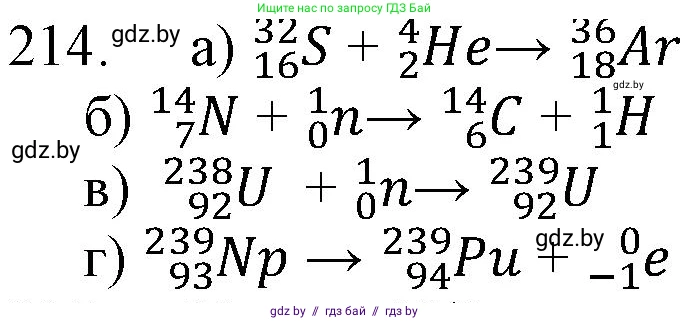
Решение 3. №214 (с. 38)
а) Для того чтобы определить недостающую частицу в ядерной реакции $ _{16}^{32}\text{S} + _{2}^{4}\text{He} = ? + _{1}^{2}\text{H} $, необходимо применить законы сохранения массового и зарядового чисел. В любой ядерной реакции сумма массовых чисел (верхние индексы) и сумма зарядовых чисел (нижние индексы) до реакции должны быть равны соответствующим суммам после реакции.
Обозначим искомую частицу как $ _{Z}^{A}\text{X} $.
Составим уравнение для массовых чисел (A):
$ 32 + 4 = A + 2 $
$ 36 = A + 2 $
$ A = 36 - 2 = 34 $
Составим уравнение для зарядовых чисел (Z):
$ 16 + 2 = Z + 1 $
$ 18 = Z + 1 $
$ Z = 18 - 1 = 17 $
Частица с массовым числом 34 и зарядовым числом 17 — это изотоп хлора (Cl).
Таким образом, полное уравнение реакции выглядит так: $ _{16}^{32}\text{S} + _{2}^{4}\text{He} = _{17}^{34}\text{Cl} + _{1}^{2}\text{H} $.
Ответ: $ _{17}^{34}\text{Cl} $.
б) Рассмотрим реакцию $ _{7}^{14}\text{N} + _{0}^{1}\text{n} = ? + _{1}^{1}\text{H} $.
Обозначим неизвестную частицу как $ _{Z}^{A}\text{X} $.
Закон сохранения массового числа:
$ 14 + 1 = A + 1 $
$ 15 = A + 1 $
$ A = 14 $
Закон сохранения зарядового числа:
$ 7 + 0 = Z + 1 $
$ 7 = Z + 1 $
$ Z = 6 $
Элемент с зарядовым числом 6 — это углерод (C). Следовательно, недостающая частица — это изотоп углерода $ _{6}^{14}\text{C} $.
Полное уравнение реакции: $ _{7}^{14}\text{N} + _{0}^{1}\text{n} = _{6}^{14}\text{C} + _{1}^{1}\text{H} $.
Ответ: $ _{6}^{14}\text{C} $.
в) Проанализируем реакцию захвата нейтрона: $ _{92}^{238}\text{U} + _{0}^{1}\text{n} = ? $.
Обозначим продукт реакции как $ _{Z}^{A}\text{X} $.
В результате захвата нейтрона ядром образуется новый изотоп того же элемента.
Массовое число нового ядра:
$ A = 238 + 1 = 239 $
Зарядовое число не меняется:
$ Z = 92 + 0 = 92 $
Элемент с зарядовым числом 92 — это уран (U). Таким образом, в результате реакции образуется изотоп урана-239.
Полное уравнение реакции: $ _{92}^{238}\text{U} + _{0}^{1}\text{n} = _{92}^{239}\text{U} $.
Ответ: $ _{92}^{239}\text{U} $.
г) Рассмотрим реакцию бета-распада: $ _{93}^{239}\text{Np} = ? + \text{e} $.
Электрон ($ \text{e} $) как частица, испускаемая при бета-распаде, имеет массовое число 0 и зарядовое число -1. Его обозначение — $ _{-1}^{0}\text{e} $.
Обозначим искомый продукт распада как $ _{Z}^{A}\text{X} $.
Закон сохранения массового числа:
$ 239 = A + 0 $
$ A = 239 $
Закон сохранения зарядового числа:
$ 93 = Z + (-1) $
$ 93 = Z - 1 $
$ Z = 93 + 1 = 94 $
Элемент с зарядовым числом 94 — это плутоний (Pu). Следовательно, в результате распада образуется изотоп плутония $ _{94}^{239}\text{Pu} $.
Полное уравнение реакции: $ _{93}^{239}\text{Np} = _{94}^{239}\text{Pu} + _{-1}^{0}\text{e} $.
Ответ: $ _{94}^{239}\text{Pu} $.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 214 расположенного на странице 38 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №214 (с. 38), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














