Номер 502, страница 111 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 3. Кислородсодержащие органические соединения. 3.1. Спирты - номер 502, страница 111.
№502 (с. 111)
Условие. №502 (с. 111)
скриншот условия
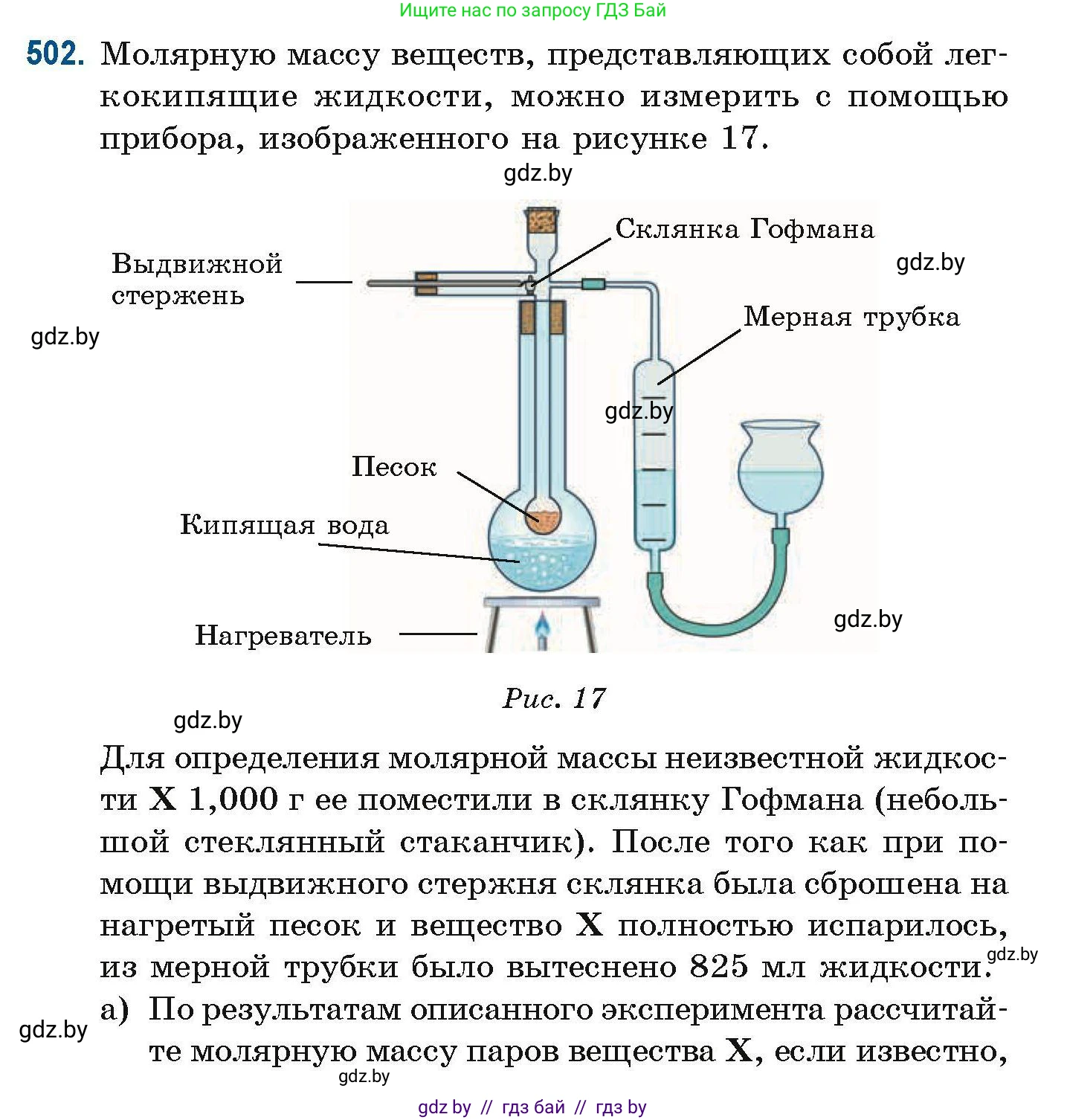

502. Молярную массу веществ, представляющих собой легкокипящие жидкости, можно измерить с помощью прибора, изображенного на рисунке 17.
Рис. 17
Для определения молярной массы неизвестной жидкости $X$ 1,000 г ее поместили в склянку Гофмана (небольшой стеклянный стаканчик). После того как при помощи выдвижного стержня склянка была сброшена на нагретый песок и вещество $X$ полностью испарилось, из мерной трубки было вытеснено 825 мл жидкости.
a) По результатам описанного эксперимента рассчитайте молярную массу паров вещества $X$, если известно, что плотность пентана, измеренная в условиях опыта, равна $2,35 \text{ г/дм}^3$.
б) Значение молярной массы вещества $X$, определенное другими методами, равно $32 \text{ г/моль}$. Установлено, что ошибка при определении молярной массы в описанном эксперименте обусловлена тем, что в парах вещество $X$ частично димеризовано. Используя правильное значение молярной массы и результаты, полученные в п. а), рассчитайте, сколько молекул $X_2$ приходится на каждые 100 молекул $X$ в парах.
в) Предложите возможную структуру вещества $X$ и объясните причину его димеризации.
Решение. №502 (с. 111)



Решение 2. №502 (с. 111)
а)
Для расчета молярной массы паров вещества $X$ воспользуемся методом сравнения с эталонным газом (пентаном), для которого известна плотность паров в тех же условиях. Согласно закону Авогадро, при одинаковых температуре ($T$) и давлении ($P$) молярные массы газов относятся как их плотности.
Из уравнения состояния идеального газа $PV = \frac{m}{M}RT$, молярную массу можно выразить как $M = \frac{m}{V} \frac{RT}{P} = \rho \frac{RT}{P}$.
Для вещества $X$ и паров пентана ($п$) в одинаковых условиях ($T$, $P$):
$M_X = \rho_X \frac{RT}{P}$
$M_п = \rho_п \frac{RT}{P}$
Разделив одно уравнение на другое, получим:
$\frac{M_X}{M_п} = \frac{\rho_X}{\rho_п} \implies M_X = M_п \frac{\rho_X}{\rho_п}$
где $M_X$ - искомая экспериментальная молярная масса вещества $X$, $M_п$ - молярная масса пентана, $\rho_X$ - плотность паров вещества $X$, $\rho_п$ - плотность паров пентана.
Дано:
Масса вещества $X$, $m_X = 1.000$ г
Объем вытесненной жидкости (объем паров $X$), $V_X = 825$ мл
Плотность паров пентана, $\rho_п = 2.35$ г/дм³
$m_X = 1.000 \cdot 10^{-3}$ кг
$V_X = 825 \cdot 10^{-3}$ л = $825 \cdot 10^{-3}$ дм³ = $825 \cdot 10^{-6}$ м³
$\rho_п = 2.35$ г/дм³ = $2.35$ кг/м³
Найти:
Экспериментальную молярную массу вещества $X$, $M_{эксп}$.
Решение:
1. Рассчитаем молярную массу пентана $C_5H_{12}$:
$M_п = 5 \cdot A_r(C) + 12 \cdot A_r(H) = 5 \cdot 12.01 + 12 \cdot 1.008 = 72.15$ г/моль.
2. Рассчитаем плотность паров вещества $X$ в условиях эксперимента:
$V_X = 825$ мл $= 0.825$ дм³
$\rho_X = \frac{m_X}{V_X} = \frac{1.000 \text{ г}}{0.825 \text{ дм³}} \approx 1.212$ г/дм³.
3. Рассчитаем экспериментальную молярную массу вещества $X$, $M_{эксп}$:
$M_{эксп} = M_п \frac{\rho_X}{\rho_п} = 72.15 \frac{\text{г}}{\text{моль}} \cdot \frac{1.212 \text{ г/дм³}}{2.35 \text{ г/дм³}} \approx 37.2$ г/моль.
Ответ: Экспериментальная молярная масса паров вещества X равна 37.2 г/моль.
б)
Ошибка в определении молярной массы вызвана частичной димеризацией вещества $X$ в парах: $2X \rightleftharpoons X_2$. Из-за этого общее число частиц в газе уменьшается, а средняя молярная масса увеличивается. Связь между экспериментальной ($M_{эксп}$) и истинной ($M_{ист}$) молярной массой при димеризации описывается через степень димеризации $\alpha$ (доля молекул мономера, вступивших в реакцию димеризации).
Пусть изначально было $n_0$ моль вещества $X$. В равновесной смеси будет $(1-\alpha)n_0$ моль мономера $X$ и $\alpha/2 \cdot n_0$ моль димера $X_2$. Общее количество вещества в смеси $n_{смеси} = (1-\alpha)n_0 + \alpha/2 \cdot n_0 = n_0(1-\alpha/2)$.
Экспериментальная молярная масса - это общая масса, деленная на общее число молей частиц: $M_{эксп} = \frac{m_X}{n_{смеси}} = \frac{n_0 \cdot M_{ист}}{n_0(1-\alpha/2)} = \frac{M_{ист}}{1-\alpha/2}$.
Дано:
$M_{эксп} \approx 37.2$ г/моль (из п. а)
$M_{ист} = 32$ г/моль
Найти:
Количество молекул $X_2$ на каждые 100 молекул $X$.
Решение:
1. Найдем степень димеризации $\alpha$:
$\alpha = 2 \left(1 - \frac{M_{ист}}{M_{эксп}}\right) = 2 \left(1 - \frac{32 \text{ г/моль}}{37.2 \text{ г/моль}}\right) = 2(1 - 0.8602) = 2(0.1398) \approx 0.280$.
2. Найдем соотношение количеств (и, следовательно, чисел молекул) димера $X_2$ и мономера $X$ в паровой фазе.
Количество мономера: $n_X = n_0(1-\alpha)$
Количество димера: $n_{X_2} = n_0(\alpha/2)$
Их отношение: $\frac{n_{X_2}}{n_X} = \frac{n_0(\alpha/2)}{n_0(1-\alpha)} = \frac{\alpha}{2(1-\alpha)}$.
3. Рассчитаем это отношение, используя найденное значение $\alpha$:
$\frac{n_{X_2}}{n_X} = \frac{0.280}{2(1-0.280)} = \frac{0.280}{2(0.720)} = \frac{0.280}{1.440} \approx 0.194$.
4. Это означает, что на 1 молекулу $X$ приходится 0.194 молекулы $X_2$. Тогда на 100 молекул $X$ будет приходиться:
$0.194 \cdot 100 = 19.4 \approx 19$ молекул $X_2$.
Ответ: На каждые 100 молекул X приходится примерно 19 молекул $X_2$.
в)
Возможная структура вещества X.
Истинная молярная масса вещества $X$ равна 32 г/моль. Этому значению соответствует метанол ($CH_3OH$):
$M(CH_3OH) = M(C) + 4 \cdot M(H) + M(O) = 12 + 4 \cdot 1 + 16 = 32$ г/моль.
Метанол является легкокипящей жидкостью (температура кипения 64.7 °C), что соответствует условию задачи. Его структурная формула $H_3C-O-H$.
Причина димеризации.
Димеризация метанола (а также образование более крупных ассоциатов) обусловлена наличием в его молекуле полярной гидроксильной группы ($-OH$). Атом кислорода обладает высокой электроотрицательностью, из-за чего на нем возникает частичный отрицательный заряд ($\delta^-$), а на связанном с ним атоме водорода – частичный положительный заряд ($\delta^+$). Кроме того, на атоме кислорода есть неподеленные электронные пары.
Благодаря этому между молекулами метанола образуются прочные межмолекулярные водородные связи. Атом водорода одной молекулы ($\delta^+$) притягивается к атому кислорода другой молекулы ($\delta^-$), образуя димер $(CH_3OH)_2$ и более сложные структуры. Эти связи достаточно прочны, чтобы сохраняться в значительной степени даже в паровой фазе при температуре 100 °C (незначительно выше температуры кипения).
Схематически образование димера за счет водородной связи можно представить так:
$CH_3-O^{\delta-}-H^{\delta+} \cdots :O^{\delta-}(H^{\delta+})-CH_3$
Ответ: Вещество X – это метанол ($CH_3OH$). Причиной его димеризации является образование межмолекулярных водородных связей между полярными гидроксильными группами (-OH) соседних молекул.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 502 расположенного на странице 111 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №502 (с. 111), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














