Номер 174, страница 33 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 1. Основные понятия и законы химии. Параграф 6. Закон Авогадро как один из основных законов химии - номер 174, страница 33.
№174 (с. 33)
Условие. №174 (с. 33)
скриншот условия

174. *Смесь карбоната магния и сульфида щелочного металла массой 24,6 г обработали избытком соляной кислоты. В результате реакции образовался раствор, содержащий хлориды общей массой 30,7 г, и выделился газ плотностью $1,8155 \text{ г/дм}^3$. Установите металл и рассчитайте массовую долю карбоната магния в исходной смеси.
Решение. №174 (с. 33)
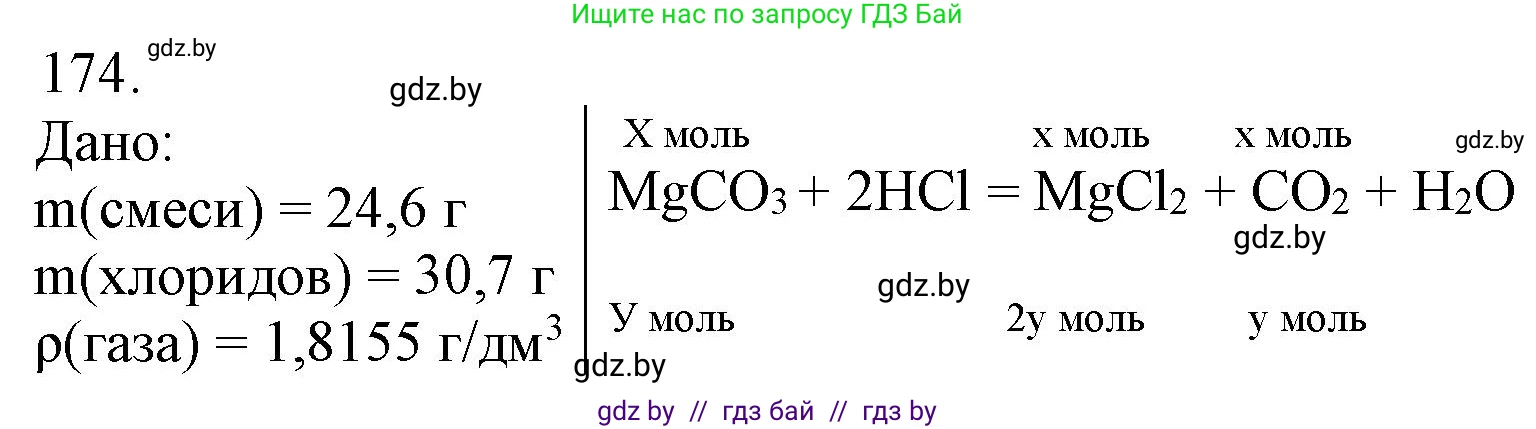

Решение 3. №174 (с. 33)
Дано:
$m(\text{смеси } MgCO_3 \text{ и } M_2S) = 24,6 \text{ г}$
$m(\text{хлоридов } MgCl_2 \text{ и } MCl) = 30,7 \text{ г}$
$\rho(\text{газовой смеси } CO_2 \text{ и } H_2S) = 1,8155 \text{ г/дм³}$
Найти:
Щелочной металл (M) - ?
$\omega(MgCO_3)$ в исходной смеси - ?
Решение:
1. Запишем уравнения реакций, протекающих при обработке смеси соляной кислотой. Пусть в исходной смеси было $x$ моль $MgCO_3$ и $y$ моль сульфида щелочного металла $M_2S$.
$MgCO_3 + 2HCl \rightarrow MgCl_2 + H_2O + CO_2\uparrow$
$M_2S + 2HCl \rightarrow 2MCl + H_2S\uparrow$
2. Из уравнений реакций следует, что количество вещества выделившихся газов составляет:
$n(CO_2) = n(MgCO_3) = x \text{ моль}$
$n(H_2S) = n(M_2S) = y \text{ моль}$
3. Найдем соотношение между $x$ и $y$ через плотность газовой смеси. Предполагая нормальные условия, молярный объем газа $V_m = 22,4 \text{ дм³/моль}$.
Средняя молярная масса газовой смеси:
$M_{ср}(\text{газов}) = \rho(\text{газов}) \cdot V_m = 1,8155 \text{ г/дм³} \cdot 22,4 \text{ дм³/моль} = 40,6672 \text{ г/моль}$
С другой стороны, средняя молярная масса выражается через молярные массы и количества веществ компонентов:
$M(CO_2) = 44 \text{ г/моль}$, $M(H_2S) = 34 \text{ г/моль}$
$M_{ср}(\text{газов}) = \frac{n(CO_2) \cdot M(CO_2) + n(H_2S) \cdot M(H_2S)}{n(CO_2) + n(H_2S)}$
$40,6672 = \frac{44x + 34y}{x + y}$
$40,6672(x+y) = 44x + 34y$
$40,6672x + 40,6672y = 44x + 34y$
$6,6672y = 3,3328x$
$x = \frac{6,6672}{3,3328}y \approx 2y$
Таким образом, мольные количества реагентов соотносятся как $x = 2y$.
4. Составим систему уравнений на основе масс исходной смеси и образовавшихся хлоридов. Обозначим молярную массу щелочного металла как $M$.
Молярные массы: $M(MgCO_3) = 84 \text{ г/моль}$, $M(M_2S) = (2M + 32) \text{ г/моль}$.
Уравнение для массы исходной смеси:
$m(MgCO_3) + m(M_2S) = x \cdot 84 + y \cdot (2M + 32) = 24,6$
Молярные массы хлоридов: $M(MgCl_2) = 95 \text{ г/моль}$, $M(MCl) = (M + 35,5) \text{ г/моль}$.
Количества веществ хлоридов: $n(MgCl_2) = x \text{ моль}$, $n(MCl) = 2y \text{ моль}$.
Уравнение для массы хлоридов:
$m(MgCl_2) + m(MCl) = x \cdot 95 + 2y \cdot (M + 35,5) = 30,7$
5. Решим систему уравнений, подставив $x = 2y$:
1) $(2y) \cdot 84 + y \cdot (2M + 32) = 24,6 \Rightarrow 168y + 2My + 32y = 24,6 \Rightarrow y(200 + 2M) = 24,6$
2) $(2y) \cdot 95 + 2y \cdot (M + 35,5) = 30,7 \Rightarrow 190y + 2My + 71y = 30,7 \Rightarrow y(261 + 2M) = 30,7$
Разделим второе уравнение на первое:
$\frac{y(261 + 2M)}{y(200 + 2M)} = \frac{30,7}{24,6}$
$24,6(261 + 2M) = 30,7(200 + 2M)$
$6420,6 + 49,2M = 6140 + 61,4M$
$280,6 = 12,2M$
$M = \frac{280,6}{12,2} = 23 \text{ г/моль}$
Атомная масса 23 г/моль соответствует щелочному металлу натрию (Na).
6. Рассчитаем массовую долю карбоната магния в исходной смеси.
Найдем $y$ из первого уравнения системы:
$y(200 + 2 \cdot 23) = 24,6 \Rightarrow y(246) = 24,6 \Rightarrow y = 0,1 \text{ моль}$
Тогда $x = 2y = 0,2 \text{ моль}$.
Масса карбоната магния в смеси:
$m(MgCO_3) = n(MgCO_3) \cdot M(MgCO_3) = 0,2 \text{ моль} \cdot 84 \text{ г/моль} = 16,8 \text{ г}$
Массовая доля карбоната магния:
$\omega(MgCO_3) = \frac{m(MgCO_3)}{m(\text{смеси})} \cdot 100\% = \frac{16,8 \text{ г}}{24,6 \text{ г}} \cdot 100\% \approx 68,3\%$
Ответ: установленный щелочной металл — натрий (Na); массовая доля карбоната магния в исходной смеси составляет 68,3%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 174 расположенного на странице 33 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №174 (с. 33), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














